معادلات كيميائية موزونة مع الحل

إن معادلات كيميائية موزونة مع الحل تأتي ضمن أولويات العديد من الطلاب.. حتى يتمكنوا من التعرف على كيفية حل تلك المعادلات المعقدة، ومن ثم يتم تطبيق تلك الطريقة على باقي المعادلات الأخرى المشابهة.. وإليك تلك التفاصيل في الفقرات القادمة.
| تعريف المعادلة الكيميائية | الرمز الكيميائي الذي يمثل التفاعل الكيميائي.. بصيغة معينة. |
| أشهر أنواع التفاعلات الكيميائية |
|
| خطوات موازنة المعادلات الكيميائية |
|
محتوى المقال
أشهر معادلات كيميائية موزونة مع الحل
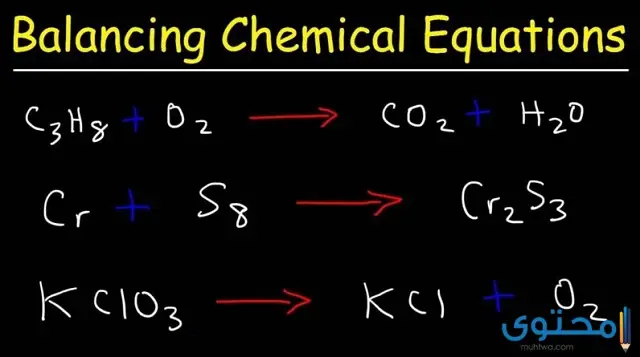
من المتعارف عليه أن المعادلات الكيميائية الموزونة تعد من بين الدروس الهامة للطلاب في مختلف المراحل.. لذا سنعرض لكم أشهر تلك المعادلات مع الحل في الآتي:
- المثال الأول: ZnS + O2 ->ZnO + SO2.. في تلك المعادلة نلاحظ أن الأكسجين شغل جهة اليسار في المعادلة وهو زوجي، بينما كان فردي في الطرف الأيمن منها.. لذا تمت مضاعفته بعد ذلك ليصبح زوجي في الجهة اليمنى كما هو موضح ZnS + O2 ->2ZnO + SO2، ومن ثم تمت الموازنة بين الزنك والكبريت والأكسجين.. لتصبح المعادلة في النهاية 2ZnS + 3O2 ->2ZnO + 2SO2.
- المثال الثاني: Pb(NO3)2 + NaCl ->NaNO3 + PbCl2.. في تلك المعادلة تم التعامل مع NO3 على أنه عنصر واحد منفرد بذاته.. فنجد أنه كان زوجيًا في الطرف الأيسر، بينما حل فرديًا جهة اليمين.. لذا تمت مضاعفة العنصر السابق ذكره باستخدام الرقم 2 ليصبح زوجيًا في الجهة اليمنى كما هو موضح Pb(NO3)2 + NaCl ->2NaNO3 + PbCl2؛ ومن ثم تمت موازنة عنصر الصوديوم لتصبح المعادلة Pb(NO3)2 + 2NaCl ->2NaNO3 + PbCl2.
اقرأ أيضًا: بحث عن الطاقة والتغيرات الكيميائية
أمثلة على معادلات كيميائية محلولة

من خلال الفقرات الحالية سنعرض لكم عدد لا بأس به.. من أهم المعادلات الكيميائية المحلولة بصورة مبسطة، وتلك المعادلات قد وردت على النحو الآتي:
- 2 As + 6 NaOH → 2 Na3AsO3 + 3 H2
- 3 Hg(OH)2 + 2 H3PO4 → Hg3 (PO4)2 + 6 H2O
- 12 HClO4 + P4O10 → 4 H3PO4 + 6 Cl2O7
- 8 CO + 17 H2 → C8H18 + 8 H2O
- 10 KClO3 + 3 P4 → 3 P4O10 + 10 KCl
- SnO2 + 2 H2 → Sn + 2 H2O
- 3 KOH + H3PO4 → K3PO4 + 3 H2O
- 2 KNO3 + H2CO3 → K2CO3 + 2 HNO3
- Na3PO4 + 3 HCl → 3 NaCl + H3PO4
- TiCl4 + 2 H2O → TiO2 + 4 HCl
- C2H6O + 3 O2 → 2 CO2 + 3 H2O
خطوات موازنة المعادلات الكيميائية
هناك بعض الخطوات التي ينبغي الالتزام بها.. في حال أن كنت ترغب في موازنة المعادلة الكيميائية الخاصة بك، وإليك تلك الخطوات على النحو التالي:
- ابدأ بكتابة المعادلة الغير متوازنة.. مع مراعاة ضرورة تدوين الصيغة الكيميائية كما هي، والتي من المفترض أن تتواجد بين السهمين كما هو الحال في المعادلات الكيميائية السابق عرضها.
- يمكنك سرد النواتج على الجانب الأيمن.. والعناصر الأخرى جهة اليسار، مع العلم أن اتجاه السهم المستخدم ينبغي أن يشير إلى الجهة التي سيحدث بها التفاعل بين العناصر المدونة.
- قم بموازنة المعادلة بالاعتماد على قانون الحفاظ على الكتلة .. والذي يتضمن ضرورة الحفاظ على العدد ذاته من الذرات عند الموازنة.
- بإمكانك في الخطوة الحالية التأكد من موازنة العنصر الحالي.. ثم بعد ذلك البدء بموازنة عنصر آخر خلافه؛ لكي تتمكن من إتمام عملية موازنة كل العناصر الكيميائية المتاحة أمامك في أقل وقت ممكن.
- ضع الفعالية المشتركة بين العناصر نصب عينيك.. لكي تتمكن من موازنة كافة العناصر والصيغ الكيميائية التي تشتمل عليها، وتجنب إضافة النصوص.. لأنها ستؤدي إلى الخلط بين الصيغ والتغير في القيمة التي تشتمل عليها كلًا منها.
- ستحتاج إلى الإشارة إلى حالات المواد المتفاعلة ومادة النواتج.. ومن هنا نجد أنه بإمكانك استخدام الحرف g في الإشارة إلى المواد الغازية، والحرف l للإشارة إلى المواد سائلة القوام.. كما يمكنك استخدام الحرف s للإشارة إلى المواد الصلبة في المعادلة.
- عقب الانتهاء من الموازنة.. سيتوجب عليك ضرورة مراجعة كل المعطيات والنتائج بتركيز شديد؛ للتعرف على ما إن كانت النواتج منطقية أم أنك بحاجة لإعادة النظر بها مرة أخرى.
طرق التحقق من صحة المعادلات الكيميائية الموزونة

وفي سياق الحديث حول معادلات كيميائية موزونة مع الحل، بالطبع سترغب في التحقق من صحة المعادلات الكيميائية خاصتك.. عقب الانتهاء من وزنها، وإليك الحل الأمثل في تلك الحالة عبر النقاط المقبلة:
- اضف رقم كل نوع من الذرات التي تشتمل عليها المعادلة الكيميائية.. في ورقة خارجية، وفي حال أن كان العدد الكلي للذرات في المعادلة الكيميائية الموزونة هو نفسه المتواجد على جانبي المعادلة.. فتلك المعادلة صحيحة من حيث النواتج.
- تأكد من أنك قد قمت بموازنة كافة العناصر التي تقع على جانبي المعادلة.. والتي تشتمل على الذرات، إذ ينبغي أن يكون العنصر الموجود في كل جانب متواجدًا أيضًا في الجانب الآخر من المعادلة الكيميائية ذاتها.
- عقب الانتهاء يمكنك التأكد من صحة النواتج.. من خلال ملاحظة أنه لا يمكنك معالجة المعاملات التي تشتمل عليها المعادلة، ففي حال أن تمكنت من تقسيم كل المعاملات على جانبي المعادلة بمقدار 2 على سبيل المثال.. فإن تلك المعادلة موزونة بالفعل.
نصائح هامة عند موازنة المعادلات الكيميائية

إلى جانب تلك النصائح والتعليمات السابق عرضها.. نجد أن هناك المزيد من التعليمات التي ستمكنك من التعرف على معادلات كيميائية موزونة مع الحل بصورة أبسط، وإليك تلك التعليمات فيما يلي:
- عند القيام بموازنة المعادلات الكيميائية المختلفة.. تذكر أنك تقوم فقط بالتغيير في قيمة المعامل أمام العنصر المتاح لك؛ لذا فإن التعديلات في تلك الحالة لا تشمل الرمز السفلي داخل المعادلة.
- ينبغي الإشارة إلى أن الأيونات ذات الذرات المتعددة عادةً ما تكون موزونة بالفعل.. كما هو الحال في المعادلات الكيميائية التي تشتمل على الأكسجين والكبريت بصورة منفصلة.
- الأفضل أن تتذكر أن موازنة الأرقام أولًا تجعلك تتلافى فرص الوقوع في الخطأ.. لأنك في تلك الحالة ستتعرف على الرقم الذي يشتمل على أعلى عدد من الذرات في النواتج التي ستحصل عليها؛ وهو ما سيتيح لك إمكانية التأكد من صحة تلك النواتج فيما بعد.
- يتوجب عليك القيام بحساب عدد الذرات في كل الجوانب التي تشتمل عليها المعادلة الكيميائية.. لكي تعرف ما إن كانت المعادلة موزونة بالشكل الصحيح، أم أنها لا زالت تحتوي على بعض العناصر التي لم تتم موازنتها بعد.
- عقب الانتهاء من موازنة المعادلة الكيميائية بنجاح من خلال التعليمات السابقة.. سيتوجب عليك التحقق من معدل الكفاءة المشتركة بين كل العناصر التي تشتمل عليها تلك المعادلة، مع العلم أنه ينبغي أن يكون الناتج هو أدنى حد لتلك الكفاءة المشتركة.
اقرأ أيضًا: بحث عن خواص المادة
تعريف المعادلات الكيميائية

من خلال التعرف على معادلات كيميائية موزونة مع الحل.. سيتسنى لك إمكانية حلها بسهولة ويسر، ومن هنا نشير إلى أن تلك المعادلات ما هي سوى رموز يتم استخدامها في الكيمياء بغرض التعرف على ما يمثله هذا التفاعل الكيميائي الواقع.
كما أن تلك العملية تحتاج في أغلب الأحيان إلى الاستعانة بالصيغ الكيميائية المختلفة.. إلى جانب ذلك فإن المعادلات الكيميائية عادةً ما تتسم بالتعقيد وتحتاج إلى التعرف على الرموز وماهيتها للتعرف على الطريقة المثلى لاستخدامها وتوظيفها على النحو الذي يتيح لك إمكانية الاستفادة منها على النحو المطلوب.
الجدير بالذكر أن تلك المعادلات تشتمل على العديد من المواد الكيميائية التي تتفاعل مع بعضها البعض والتي تتشارك معًا.. للحصول على النتائج المرجوة، علاوة على أنها تتكون من طرفين.. فالأول يشار إليه باسم المتفاعلات.
فيما يعرف الطرف الثاني من تلك المعادلات المعقدة باسم النواتج.. ومن هنا يمكننا القول بأن المتفاعلات في تلك العملية تمثل العناصر التي يتم التفاعل فيما بينها داخل نطاق التفاعل الكيميائي .
أما عن النواتج فهي تلك العناصر التي يتم الحصول عليها في نهاية التفاعل.. والتي تتواجد في الأغلب ناحية اليمين من المعادلة المدونة، وتجدر الإشارة إلى أنه ينبغي أن تكون الكميات المستخدمة في المعادلة أو ما تعرف باسم المواد المتفاعلة مساوية للكميات الناتجة عن المعادلة.. لكي يتسنى لك إمكانية الحصول على النتائج الصحيحة.
اقرأ أيضًا: بحث عن أثار التفاعلات الكيميائية على البيئة
أنواع التفاعلات الكيميائية

تشتمل تلك التفاعلات الكيميائية على العديد من الأنواع.. التي تختلف عن بعضها البعض من حيث الخصائص، وإليك أهم تلك الأنواع في الآتي:
- المزج والاتحاد: عبارة عن تفاعلات تحدث بين المواد البسيطة التي يتم مزجها معًا.. والتي من خلالها يتم إنتاج مادة جديدة أكثر تعقيدًا من المواد الأولية التي تشتمل عليها المعادلة الكيميائية نفسها.. والمعادلة الكيميائية هي: A+B→AB.
- تفاعلات التفكك أو التحلل: تعتمد على تكسير الروابط بين العناصر المكونة للمركب الكيميائي.. والتي تهدف في الأساس إلى إعادته إلى العناصر الأولية التي تكون منها، ومن أشهر الأمثلة الواردة في هذا النوع عملية التحليل الكهربائي للماء.. والتي تقوم بفصل ذرات الأكسجين عن الهيدروجين؛ بغرض إعادته إلى الغازين المنفرجين.. كما يحدث في المعادلة التالية: AB→A+B.
- تفاعلات الإحلال أو الاستبدال: تلك التفاعلات تحدث بين مركبين كيميائيين.. حيث يتم كسر الروابط بين العناصر المكونة لهما، ومن ثم يتم تكوين روابط جديدة لتحل محل القديمة.. كما هو الحال في المعادلة الآتية: AB+CD→AC+BD.
- تفاعلات التحلل المائي: تحدث تلك العملية لمركب الماء حين يتحول إلى أيون الهيدروجين الموجب.. وجزيء الهيدروكسيد السالب؛ وعليه فإن الماء يرتبط مع الأيون السالب الذي تفاعل معه من قبل.. ليبقى الهيدروكسيد وحيدًا بمفرده، وذلك كما في المعادلة التالية: X-aq+ H2O l →HX aq + OH-aq.
- تفاعلات الإحلال الأحادي: تتم تلك العملية في حال أن تم إزاحة عنصر من مركب.. بالاعتماد على عنصر آخر أكثر نشاطًا منه، وفي تلك الحالة يتم الحصول على مكانه في المركب ذاته.. وبالنسبة إلى المعادلة الكيميائية التي تشرح تلك العملية، فقد ورد كالتالي: AB+C→AC+B.
- تفاعلات التأكسد والاختزال: في تلك العملية الكيميائية يتم نقل الإلكترون بين المواد المتفاعلة.. حيث يقع تغير في عدد التأكسد التابع إلى العناصر المتفاعلة؛ وتكون النتيجة الحتمية هو أن أحد تلك العناصر يكتسب والآخر يفقد.. كما يتم اتحاد العنصر مع العامل المؤكسد؛ بهدف إنتاج الطاقة فيما بعد.
- تفاعلات التعادل: يتم فيها تغيير البنية الهيكلية للمركب.. مع مراعاة أن التركيب الذري للمادة يبقى كما هو.
من خلال الاطلاع على معادلات كيميائية موزونة مع الحل.. سيتسنى لك إمكانية التعرف على القاعدة الأساسية التي يتم الاعتماد عليها عند حل تلك المعادلات؛ ومن ثم سيصبح من السهل تطبيقها على المعادلات الأخرى.

التعليقات